 |
||||||||||||||||||||
|
国际创新药物研发和管理高级课程 Chinese Course on Drug Development and Regulatory Sciences, CCDRS 2018年,北京大学,北京 |
||||||||||||||||||||
|
北京大学临床研究所 |
||||||||||||||||||||
| 火热报名中 | ||||||||||||||||||||
| 历时十年,精心打造 | ||||||||||||||||||||
|
² 国际认可的高水平课程 ² 内容囊括创新药物从研发到上市管理全过程 ² 既有全球药业环境纵览与展望,又有具体技术问题的深入学习和讨论 ² 为学员提供基于案例的,和专家及同行进行面对面讨论的机会,同时帮 助学员构建国际国内合作网络,为未来职业生涯做准备
|
||||||||||||||||||||
 |
||||||||||||||||||||
| 管理委员会 | ||||||||||||||||||||
 |
||||||||||||||||||||
|
Carl C. Peck MD
成员 美国加州大学旧金山分校ACDRS课程创始人
美国FDA-CDER前主任 |
||||||||||||||||||||
课程委员会 |
||||||||||||||||||||
课程主要内容 |
||||||||||||||||||||
|
第一模块
全球药物研发宏图和制药业环境 (2018.3.13-17)
l 卫生体系与卫生改革 l 制药工业及监管概况 l 制药业的重要趋势 l 药物研发过程 l 价值和伦理 l 新药研发的监管政策 l 早期药物研发考虑事项和新分子发现 为药物临床试验做准备
|
||||||||||||||||||||
|
第二模块
分子发现、临床前实验和基于建模的概念验证 (2018.6.12-16) l 药物早期临床前和临床试验 l First in Human l 剂量- 反应与个体化的药代动力学和药效学 l 早期临床概念验证实验和全面的药物研发决策 l 药物研发中的新疗法 药物研发早期毒性的发现和解释
|
||||||||||||||||||||
|
第三模块
后期确证性临床试验的方法与需考虑事项 (2018.8.21-25) l 基本概念和研究设计 l 数据分析、描述和 l 案例讨论 l 药物安全与Meta 分析 l 不同疾病的临床试验 l 现实世界实践问题 |
||||||||||||||||||||
|
第四模块
全球创新药物注册,上市后发展和商业考虑 (2018.11.13-17) l 全球药物注册和创新 l 如何做出监管决策 l 设计和实施高质量、有价值的上市后研究 l 药品安全问题 l 药物经济学与药品定价 l 药物知识产权和超说明书用药 |
||||||||||||||||||||
| 您能从课程中获得什么 | ||||||||||||||||||||
|
² 为应对未来全球制药环境发展变化做准备,从而在产品选择、研发、监管和商业评估中做出正确决策 ² 设计、评估和管理药物研发的整体计划及由此计划产生的研发产品,并在研发过程的不同阶段做出是否继续的决策 ² 充分理解公司其他部门职能,与之进行高效交流 ² 理解本国和全球监管部门对药物研发的基本要求 ² 为未来的职业生涯做准备 ² 完成全部四个模块并通过考试者,将获得三方联合颁发的结业证书。
|
||||||||||||||||||||
| 报名注册 | ||||||||||||||||||||
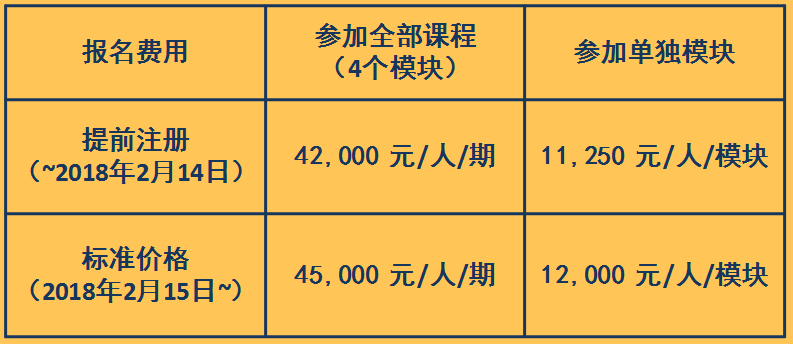 |
||||||||||||||||||||
|
为了保证课程质量,招生人数将被限制在每期80 人。 |
||||||||||||||||||||
| 报名方式 | ||||||||||||||||||||
|
通过电子邮件发送注册表注册( 注册表下载地址:http://bd.le-q.cn/DownLoad2. aspx?m=20100107163154223684) |
||||||||||||||||||||
| 联系方式 | ||||||||||||||||||||
|
联系电话:86-10-8285563-506 E-mail:pucri_zhangxf@bjmu.edu.cn
|
||||||||||||||||||||
















