
定量结果显示,中国临床试验质量在过去十余年显著提升。
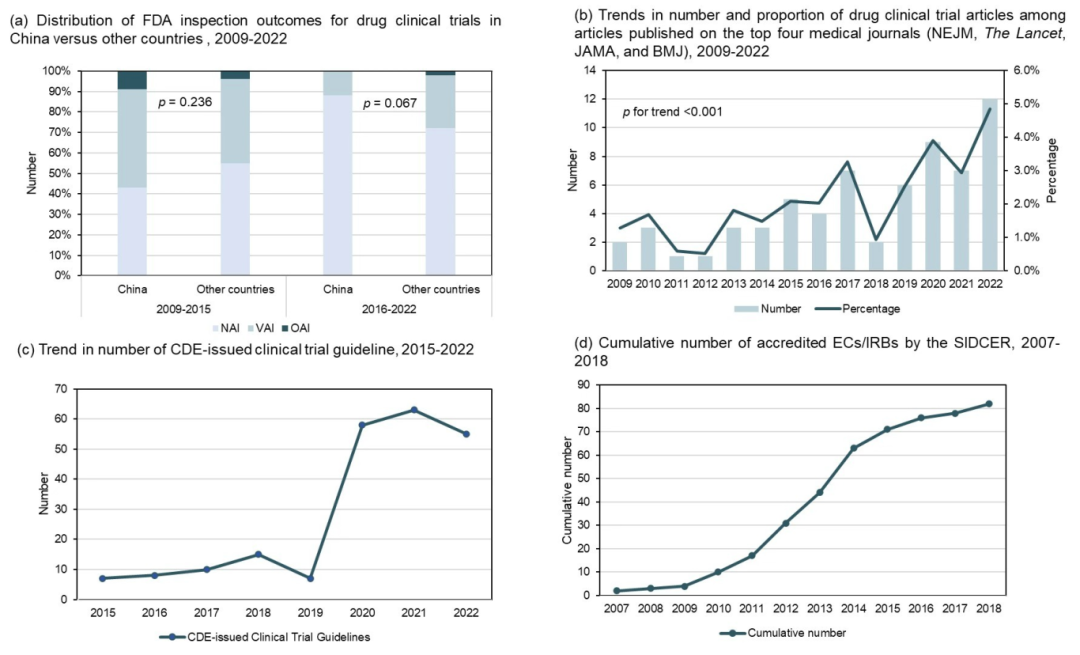
◆FDA现场核查数据:中国临床试验机构“无需采取监管措施(No Action Indicated)”的比例由2009-2015年的43%增至2016-2022年的88%,而“需采取官方措施(Official Action Indicated)”的比例由9%降至0%。
◆国家药监局核查结果:2015-2017年有12%的现场核查涉嫌数据造假,2022年仅0.6%的注册核查不通过。
◆高质量证据产出数量:中国机构在四大医学期刊(NEJM、Lancet、JAMA、BMJ)以第一或通讯作者发表的药物临床试验文章在全球的占比由2009年的1.3%增至2022年的4.9%。
◆CDE发布的临床试验相关指南数量: 2015-2019年平均每年10项,2020-2022年平均每年50-60项。
SIDCER认证伦理委员会数量:2009年为4家,2022年为82家。
◆截至2024年,全国已建立50个国家临床医学研究中心和13个国家医学中心,累计备案1649家药物临床试验机构。
◆FDA现场核查数据:中国临床试验机构“无需采取监管措施(No Action Indicated)”的比例由2009-2015年的43%增至2016-2022年的88%,而“需采取官方措施(Official Action Indicated)”的比例由9%降至0%。
◆国家药监局核查结果:2015-2017年有12%的现场核查涉嫌数据造假,2022年仅0.6%的注册核查不通过。
◆高质量证据产出数量:中国机构在四大医学期刊(NEJM、Lancet、JAMA、BMJ)以第一或通讯作者发表的药物临床试验文章在全球的占比由2009年的1.3%增至2022年的4.9%。
◆CDE发布的临床试验相关指南数量: 2015-2019年平均每年10项,2020-2022年平均每年50-60项。
SIDCER认证伦理委员会数量:2009年为4家,2022年为82家。
◆截至2024年,全国已建立50个国家临床医学研究中心和13个国家医学中心,累计备案1649家药物临床试验机构。
定性访谈发现进一步支持了定量研究结果。研究对39名临床试验相关方进行了定性访谈,其中申办方21名、CRO 5名、临床试验机构9名、监管部门4名。
◆所有受访者均认为我国临床试验质量显著提升。
◆依据访谈内容整理出18项对于提升我国药物临床试验质量具有关键作用的法律、法规和指南。
◆受访者普遍提到法规体系完善、核查制度优化、研究者能力提升、GCP办公室管理改进、伦理委员会能力强化、专业人员技能提升与信息化应用,是影响临床试验质量的关键因素,并进一步提出了改进建议。
✪综上,研究从五个方面提出提升中国药物临床试验质量的策略:
01加快政策的落地和实施
当前我国药物临床试验法规管理体系已经初具规模,未来应加强政策执行力度,在现有基础上持续完善指导原则和技术指南,推进我国与ICH技术标准和指南的协调统一。
02完善监管核查体系建设
应落实基于风险的核查,进一步建设核查队伍、统一核查标准,逐步将核查对象扩展至申办方、CRO和伦理委员会,并公开核查结果,提高监管透明度。
03推动临床研究平台建设
现代临床研究体系包括临床研究技术支撑体系和受试者保护体系。专业化临床研究技术支撑体系应由富有研究经验的方法学团队、能够保障临床研究高质量开展的标准化操作规程、临床研究数据采集和管理平台、高水平的数据管理与统计分析技术团队组成。受试者保护体系应包括伦理委员会及审查制度、现场监查监督的质量保证体系、科研诚信保障体系和科技伦理与科研诚信教育培训体系。
04提高临床研究能力
建设临床科学家培养体系,在医科院校中发展“临床研究方法学”学科建设,面向医学院校研究生开设相关课程,选拔一批中青年优秀临床医师定向培养,以加强临床实践与创新研究设计的衔接。
05推进人工智能规范应用
人工智能可用于试验设计、受试者招募、生物模拟及数据管理等环节,应尽早建立相应的技术标准和伦理规范,加强隐私与偏倚风险防控,并提升临床试验相关方的技术应用能力。
论文链接:http://doi.org/10.1111/jebm.70085
论文并列第一作者:北京大学临床医学高等研究院陈夏燕博士生和北京大学第三医院褚红玲副研究员。
论文通讯作者:北京大学临床医学高等研究院武阳丰教授。
◆所有受访者均认为我国临床试验质量显著提升。
◆依据访谈内容整理出18项对于提升我国药物临床试验质量具有关键作用的法律、法规和指南。
◆受访者普遍提到法规体系完善、核查制度优化、研究者能力提升、GCP办公室管理改进、伦理委员会能力强化、专业人员技能提升与信息化应用,是影响临床试验质量的关键因素,并进一步提出了改进建议。
✪综上,研究从五个方面提出提升中国药物临床试验质量的策略:
01加快政策的落地和实施
当前我国药物临床试验法规管理体系已经初具规模,未来应加强政策执行力度,在现有基础上持续完善指导原则和技术指南,推进我国与ICH技术标准和指南的协调统一。
02完善监管核查体系建设
应落实基于风险的核查,进一步建设核查队伍、统一核查标准,逐步将核查对象扩展至申办方、CRO和伦理委员会,并公开核查结果,提高监管透明度。
03推动临床研究平台建设
现代临床研究体系包括临床研究技术支撑体系和受试者保护体系。专业化临床研究技术支撑体系应由富有研究经验的方法学团队、能够保障临床研究高质量开展的标准化操作规程、临床研究数据采集和管理平台、高水平的数据管理与统计分析技术团队组成。受试者保护体系应包括伦理委员会及审查制度、现场监查监督的质量保证体系、科研诚信保障体系和科技伦理与科研诚信教育培训体系。
04提高临床研究能力
建设临床科学家培养体系,在医科院校中发展“临床研究方法学”学科建设,面向医学院校研究生开设相关课程,选拔一批中青年优秀临床医师定向培养,以加强临床实践与创新研究设计的衔接。
05推进人工智能规范应用
人工智能可用于试验设计、受试者招募、生物模拟及数据管理等环节,应尽早建立相应的技术标准和伦理规范,加强隐私与偏倚风险防控,并提升临床试验相关方的技术应用能力。
论文链接:http://doi.org/10.1111/jebm.70085
论文并列第一作者:北京大学临床医学高等研究院陈夏燕博士生和北京大学第三医院褚红玲副研究员。
论文通讯作者:北京大学临床医学高等研究院武阳丰教授。




